فهرست عناوین
- مقدمه ای بر کلر
- ترکیب شیمیایی کلر : مولکول ها و ایزوتوپ ها
- خصوصیات فیزیکی کلر : حالت ، دما و فشار
- ساختار مولکولی کلر و پیوندهای شیمیایی
- رنگ ، بو و ویژگی های ظاهری کلر
- واکنش های شیمیایی کلر با عناصر
- نقش کلر در ترکیب های شیمیایی و نمک
- کلر و تأثیرات آن در تصفیه آب
- ترکیب های آلی کلر : دما و کاربردهای صنعتی
- تفاوت کلر با سایر هالوژن ها
- کلر در تولید محصولات ضدعفونی کننده
- تأثیرات کلر بر سلامت انسان و روش های ایمنی
نوشته شده توسط شرکت صنایع کلر ایران
منتشر شده توسط شرکت صنایع کلر ایران
تاریخ انتشار مقاله : 29-10-1403
تاریخ بروزرسانی مقاله : 29-10-1403
تعداد کلمات : 2500
آدرس مقاله : لینک مقاله
خصوصیات شیمیایی و فیزیکی کلر

مقدمه ای بر کلر
کلر عنصری با اهمیت فراوان در شیمی و صنعت ، گازی زرد-سبز رنگ با بوی تند و زننده است. که به راحتی قابل تشخیص است. این عنصر هالوژن با عدد اتمی 17، در گروه 17 جدول تناوبی قرار دارد و به دلیل واکنش پذیری بالا به ندرت به صورت آزاد در طبیعت یافت می شود. کلر در ترکیباتی مانند کلرید سدیم (نمک طعام) به وفور وجود دارد. خواص شیمیایی کلر عمدتا ناشی از تمایل شدید آن به جذب یک الکترون و تشکیل آنیون کلرید (Cl⁻) است. این خاصیت باعث واکنش پذیری بالای آن با بسیاری از عناصر و ترکیبات می شود. کلر به عنوان یک عامل اکسیدکننده قوی شناخته می شود و در واکنش های مختلف از جمله واکنش های جانشینی و افزایشی شرکت می کند. کاربردهای صنعتی گسترده ای در گندزدایی آب ، تولید مواد شیمیایی مختلف مانند پلاستیک ها و حلال ها و همچنین در تولید مواد سفیدکننده دارد.
ترکیب شیمیایی کلر : مولکول ها و ایزوتوپ ها
کلر (Cl) عنصری شیمیایی با عدد اتمی 17 است که به صورت مولکول دو اتمی (Cl₂) در طبیعت یافت می شود. این مولکول پیوندی کووالانسی غیرقطبی بین دو اتم کلر دارد. این پیوند ناشی از اشتراک یک جفت الکترون بین دو اتم است که به پایداری مولکول می انجامد. کلر دو ایزوتوپ پایدار اصلی دارد: ³⁵Cl (حدود ۷۵.۷۷ درصد فراوانی) و ³⁷Cl (حدود ۲۴.۲۳ درصد فراوانی). این ایزوتوپ ها تنها در تعداد نوترون ها با هم تفاوت دارند ³⁵Cl دارای ۱۸ نوترون و ³⁷Cl دارای ۲۰ نوترون است و هر دو در تشکیل مولکول Cl₂ شرکت می کنند.
وزن اتمی متوسط کلر در حدود 35.45 u است که میانگین وزن این دو ایزوتوپ با توجه به فراوانی طبیعی آنهاست. وجود ایزوتوپ های مختلف باعث پدیدار شدن پیک های مختلف در طیف سنجی جرمی کلر می شود. و این ویژگی در تحلیل کمی و کیفی نمونه ها کاربرد دارد. علاوه بر ایزوتوپ های پایدار ، ایزوتوپ های رادیواکتیو کلر نیز وجود دارند که کاربردهای خاصی در علوم هسته ای و پزشکی دارند. ترکیب شیمیایی کلر در ترکیبات مختلف بسیار متنوع است و از تشکیل پیوندهای یونی با فلزات مانند NaCl تا ایجاد پیوندهای کووالانسی با نافلزات مانند CCl₄ را شامل می شود.
خصوصیات فیزیکی کلر : حالت ، دما و فشار
کلر (Cl₂) در شرایط استاندارد (دمای اتاق و فشار اتمسفر) به صورت گاز وجود دارد. این گاز زرد-سبز رنگ ، بوی تند و زننده ای دارد که به راحتی قابل تشخیص است. نقطه ذوب کلر 101.5- درجه سانتیگراد و نقطه جوش آن 34.04- درجه سانتیگراد است. این مقادیر پایین نشان دهنده ی نیروی های بین مولکولی ضعیف در مولکول های Cl₂ هستند. پیوند بین دو اتم کلر پیوندی کووالانسی غیرقطبی است که در نتیجه ی آن نیروهای بین مولکولی ضعیف واندروالس برهم کنش بین مولکول ها را تعیین می کنند. فشار بخار کلر در دمای اتاق نسبتا بالاست که نشان دهنده تمایل مولکول ها به تبدیل از حالت مایع به گاز است.
این ویژگی در خرید کلر کلرپارس تبریز 65 درصد و کاربردهای صنعتی کلر مانند حمل و نقل و ذخیره سازی آن بسیار حائز اهمیت است و نیازمند رعایت نکات ایمنی خاص است. دانستن دقیق نقطه ذوب ، نقطه جوش و فشار بخار کلر برای طراحی سیستم های مناسب ذخیره سازی و همچنین در محاسبات ترمودینامیکی واکنش های شیمیایی شامل کلر بسیار ضروری است. تغییرات در دما و فشار به طور قابل توجهی روی حالت فیزیکی کلر و رفتار آن در واکنش ها تاثیر می گذارد. به عنوان مثال تحت فشار بالا و دمای پایین کلر به حالت مایع تبدیل می شود.
ساختار مولکولی کلر و پیوندهای شیمیایی
کلر (Cl₂) به صورت یک مولکول دو اتمی خطی وجود دارد که در آن دو اتم کلر با یک پیوند کووالانسی غیرقطبی به هم متصل شده اند. این پیوند ناشی از اشتراک یک جفت الکترون بین دو اتم کلر با الکترونگاتیوی تقریباً برابر است. هر اتم کلر هفت الکترون در لایه ظرفیت خود دارد و با اشتراک یک الکترون با اتم دیگر به آرایش پایدار گاز نجیب آرگون (هشت الکترون در لایه ظرفیت) می رسد. طول پیوند Cl-Cl در حدود 198 پیکومتر است. در ترکیبات کلردار ، کلر می تواند پیوندهای مختلفی تشکیل دهد. در ترکیبات یونی مانند سدیم کلرید (NaCl)، کلر یک الکترون از سدیم دریافت می کند.
و به آنیون کلرید (Cl⁻) با بار منفی تبدیل می شود. پیوند بین سدیم کاتیون (Na⁺) و آنیون کلرید پیوندی یونی است که ناشی از نیروی جاذبه الکترواستاتیکی بین بارهای مخالف است. در مقابل در ترکیبات کووالانسی مانند متان کلرید (CH₃Cl) کلر با کربن پیوند کووالانسی تشکیل می دهد. در این پیوند کلر و کربن یک جفت الکترون را به صورت مشترک به اشتراک می گذارند. اگرچه به دلیل اختلاف الکترونگاتیوی پیوند کمی قطبی است. نوع پیوند کلر در ترکیبات مختلف به الکترونگاتیوی اتم هایی که با کلر پیوند تشکیل می دهند بستگی دارد. هرچه اختلاف الکترونگاتیوی بیشتر باشد پیوند بیشتر به سمت یونی تمایل دارد.
| ویژگی | توضیحات | کاربردها | نقاط ذوب و جوش | چگالی | خطرات ایمنی |
|---|---|---|---|---|---|
| فرمول مولکولی | Cl₂ | ضدعفونیکننده و سفیدکننده | نقطه ذوب: -101°C | نقطه جوش: -34°C | 3.2 g/L (در دمای اتاق) | سمی، تحریککننده چشم و پوست |
| شکل هندسی | خطی | تولید مواد شیمیایی | نقطه ذوب: -101°C | نقطه جوش: -34°C | 3.2 g/L (در دمای اتاق) | سمی، تحریککننده چشم و پوست |
| نوع پیوند | کووالانسی غیرقطبی | ساخت ترکیبات آلی | نقطه ذوب: -101°C | نقطه جوش: -34°C | 3.2 g/L (در دمای اتاق) | سمی، تحریککننده چشم و پوست |
| طول پیوند | 1.99 Å | مهندسی شیمی | نقطه ذوب: -101°C | نقطه جوش: -34°C | 3.2 g/L (در دمای اتاق) | سمی، تحریککننده چشم و پوست |
| زاویه پیوند | 180 درجه | تحقیقات شیمیایی | نقطه ذوب: -101°C | نقطه جوش: -34°C | 3.2 g/L (در دمای اتاق) | سمی، تحریککننده چشم و پوست |
رنگ ، بو و ویژگی های ظاهری کلر
کلر (Cl₂) در شرایط استاندارد ، گازی است با رنگ زرد-سبز روشن و بوی تند و زننده که به راحتی قابل تشخیص است. این بو اغلب با بوی مواد شوینده ی خانگی که حاوی ترکیبات کلردار هستند مقایسه می شود. رنگ زرد-سبز کلر به جذب و انتشار نور در ناحیه ی مرئی طیف الکترومغناطیسی مربوط است. این جذب و انتشار در طول موج های خاص باعث می شود که ما رنگ زرد-سبز را درک کنیم. چگالی کلر از هوا بیشتر است و به همین دلیل در صورت نشت تمایل به تجمع در نواحی پایین تر دارد. در حالت مایع کلر زرد طلایی رنگ است و به دلیل ویژگی های خورنده برای ذخیره سازی آن باید از ظروف مقاوم به خوردگی استفاده شود. این ویژگی های ظاهری همراه با سمی بودن کلر ضرورت رعایت شدید نکات ایمنی در کار با این ماده را نشان می دهند. مشاهده رنگ و بوی غیرعادی در هنگام کار با کلر نشانه نشت احتمالی است. و باید فورا اقدامات ایمنی لازم انجام شود.
واکنش های شیمیایی کلر با عناصر
کلر به عنوان یک عامل اکسید کننده قوی با طیف وسیعی از عناصر واکنش نشان می دهد. واکنش پذیری بالای آن به دلیل تمایل شدید به کسب یک الکترون برای رسیدن به آرایش پایدار گاز نجیب آرگون است.
کلر با هیدروژن به طور مستقیم واکنش داده و هیدروژن کلرید (HCl) تولید می کند. این واکنش گرمازا بوده و در حضور نور به سرعت انجام می گیرد. HCl یک گاز محلول در آب است که اسید قوی کلریدریک را تشکیل می دهد.
کلر با سدیم به شدت واکنش داده و سدیم کلرید (NaCl) یا نمک طعام تولید می کند. این یک واکنش گرمازا و یونی است که در آن سدیم الکترون خود را به کلر می دهد و کاتیون سدیم (Na⁺) و آنیون کلرید (Cl⁻) تشکیل می شوند. جاذبه ی الکترواستاتیکی بین این یون ها پیوند یونی قوی در NaCl ایجاد می کند.
واکنش کلر با کربن به شرایط واکنش بستگی دارد. در دماهای بالا کلر با کربن واکنش داده و تتراکلرید کربن (CCl₄) یا سایر کلروکربن ها را تولید می کند. این واکنش ها در صنعت برای تولید حلال ها و سایر ترکیبات آلی مورد استفاده قرار می گیرند. در این واکنش ها پیوندهای کووالانسی بین کربن و کلر تشکیل می شوند.
واکنش پذیری کلر با عناصر مختلف نشان دهنده حائز اهمیت بودن تاریخچه کشف کلر و تحولات تاریخی آن و همچنین اهمیت این عنصر در شیمی و کاربردهای متنوع آن در صنایع مختلف است. نوع پیوند تشکیل شده در واکنش کلر با عناصر مختلف یونی یا کووالانسی به الکترونگاتیوی نسبی عناصر درگیر بستگی دارد.
نقش کلر در ترکیب های شیمیایی و نمک
کلر عنصری با الکترونگاتیوی بالا نقش اساسی در تشکیل ترکیبات شیمیایی متنوع به ویژه نمک ها ایفا می کند. تمایل شدید آن به پذیرش یک الکترون برای تکمیل لایه ظرفیت منجر به تشکیل پیوندهای یونی قوی با فلزات می شود. نمکی مانند سدیم کلرید (NaCl) مثال بارزی از این پیوند است که در آن یک اتم کلر یک الکترون از سدیم دریافت کرده و آنیون کلرید (Cl⁻) و کاتیون سدیم (Na⁺) را تشکیل می دهند. جاذبه ی الکترواستاتیکی بین این یون ها ساختار کریستالی NaCl را ایجاد می کند. کلر همچنین در تشکیل ترکیبات کووالانسی مشارکت دارد. در این ترکیبات کلر الکترون ها را با نافلزات به اشتراک می گذارد. مثال هایی از این ترکیبات شامل هیدروژن کلرید (HCl) یک اسید قوی و تتراکلرید کربن (CCl₄) یک حلال آلی هستند.
کاربردهای ترکیبات کلردار بسیار گسترده است. NaCl علاوه بر استفاده روزمره به عنوان نمک طعام در صنایع مختلف مانند تولید مواد شیمیایی ، صنایع غذایی و تصفیهی آب به کار می رود. HCl در صنایع شیمیایی برای تولید انواع مواد شیمیایی و CCl₄ (با وجود خطرات زیست محیطی) به عنوان حلال استفاده می شد. درک نقش کلر در تشکیل این ترکیبات برای شناخت ویژگی ها و کاربردهای آن ها بسیار مهم است.
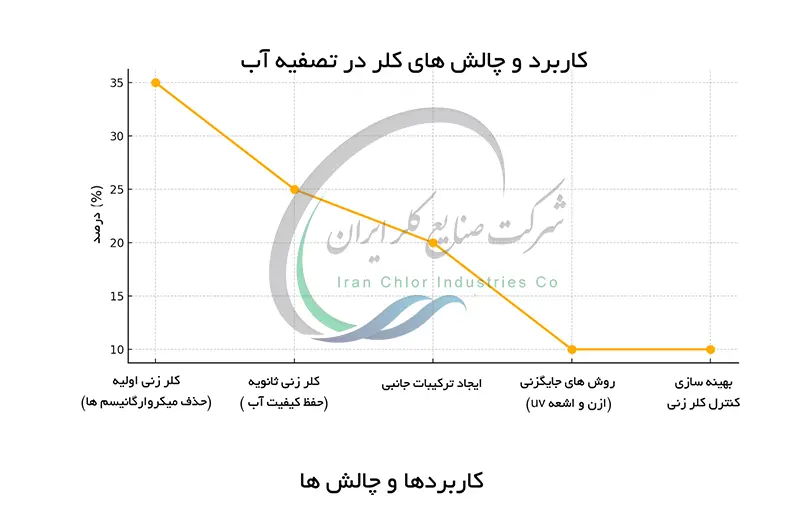
کلر و تأثیرات آن در تصفیه آب
کلر (Cl₂) به عنوان یک عامل اکسیدکننده قوی در تصفیه ی آب به کار می رود. خواص اکسیدکنندگی قوی آن موجب از بین رفتن پاتوژن ها (میکروارگانیسم های بیماری زا) مانند باکتری ها ، ویروس ها و برخی انگل ها در آب می شود. این عمل به طور چشمگیری خطر ابتلا به بیماری های منتقله از طریق آب را کاهش می دهد. در فرایند تصفیه ی آب کلر به دو صورت به کار می رود : کلرزنی اولیه که معمولاً در مراحل اولیه ی تصفیه برای از بین بردن میکروارگانیسم ها انجام می شود.
و کلرزنی ثانویه که برای حفظ کیفیت آب در طول توزیع و جلوگیری از رشد مجدد میکروارگانیسم ها در شبکهی توزیع آب استفاده می شود. با این حال استفاده از کلر در تصفیه ی آب بدون چالش نیست. تولید ترکیبات جانبی کلر (DBPs) در اثر واکنش کلر با مواد آلی موجود در آب یک نگرانی جدی است. برخی از DBPها اثرات مضر سلامتی دارند. به همین دلیل روش های جایگزین و یا ترکیبی برای تصفیه ی آب مانند استفاده از ازن یا اشعه UV در حال بررسی و استفاده هستند. بهینه سازی فرایند کلرزنی و کنترل دقیق میزان کلر اضافه شده نقش مهمی در به حداقل رساندن خطرات مرتبط با DBPها دارد.
ترکیب های آلی کلر : دما و کاربردهای صنعتی
ترکیبات آلی کلر دسته وسیعی از ترکیبات شیمیایی هستند که حداقل یک اتم کلر به یک مولکول آلی متصل است. این ترکیبات در طیف وسیعی از دماها پایدار هستند و خواص فیزیکی و شیمیایی متفاوتی دارند که به ساختار مولکولی آن ها بستگی دارد. کلروفرم (CHCl₃) یک حلال آلی فرار و بی رنگ است که در دمای اتاق مایع است و نقطه جوش آن 61.2 درجه سانتیگراد است. در گذشته به عنوان بیهوشی استفاده می شد اما به دلیل اثرات سمی و سرطان زایی کاربردهای آن محدود شده است. کاربردهای صنعتی ترکیبات آلی کلر بسیار متنوع است.
از جمله می توان به : حلال ها (مانند تتراکلریدکربن و کلروفرم) ، مواد اولیه در تولید پلاستیک های PVC ، خنک کننده ها (مانند فرئون ها اگرچه استفادهی بسیاری از آن ها به دلیل تخریب لایه ازون ممنوع شده است) ، حشرهکش ها مانند DDT که به دلیل سمیت زیست محیطی استفاده ی آن ممنوع شده است. و سایر کاربردهای تخصصی اشاره کرد. دمای کار با ترکیبات آلی کلر بسته به ترکیب خاص و کاربرد آن متفاوت است. بسیاری از این ترکیبات در دماهای محیطی قابل استفاده هستند اما برخی از آن ها نیاز به کنترل دمایی دقیق دارند. باید به این نکته توجه داشت که بسیاری از ترکیبات آلی کلر سمی و یا خطرناک هستند و باید با رعایت کامل نکات ایمنی با آن ها کار شود.
تفاوت کلر با سایر هالوژن ها
کلر (Cl) عضوی از خانواده هالوژن ها در جدول تناوبی است که ویژگی های شیمیایی مشترکی با فلوئور (F)، برم (Br) و ید (I) دارد. با این حال تفاوت های قابل توجهی نیز بین آن ها وجود دارد.
فلوئور الکترونگاتیوترین عنصر است و واکنش پذیری بالاتری نسبت به کلر دارد. ید کمترین الکترونگاتیوی را در این گروه دارد و کمترین واکنش پذیری را نشان می دهد. کلر الکترونگاتیوی متوسطی دارد و در مقایسه با فلوئور واکنش پذیری کمتری نشان می دهد اما واکنش پذیری آن از برم و ید بیشتر است. حالت فیزیکی کلر در دمای اتاق گاز است در حالی که برم مایع و ید جامد است.
فلوئور به طور گسترده در تولید ترکیبات مختلف از جمله تفلون و برخی از داروها استفاده می شود. کلر در تصفیه آب ، تولید پلاستیک ها (PVC) و بسیاری از ترکیبات شیمیایی دیگر کاربرد دارد. برم در مواد ضد آتش و برخی از داروها استفاده می شود. ید در پزشکی (به عنوان ضدعفونی کننده) و در برخی از فرآیندهای صنعتی کاربرد دارد. هالوژن ها اگرچه ویژگی های مشترک بسیاری دارند اما تفاوت هایی در الکترونگاتیوی ، واکنش پذیری ، حالت فیزیکی و کاربردهایشان دارند که آن ها را از یکدیگر متمایز می کند.
کلر در تولید محصولات ضدعفونی کننده
کلر به دلیل خواص اکسیدکنندگی قوی خود نقش اساسی در تولید طیف وسیعی از محصولات ضدعفونی کننده و بهداشتی دارد. فرم رایج آن در این کاربردها هیپوکلریت سدیم (NaClO) است که به عنوان سفیدکننده و ضدعفونی کننده خانگی شناخته می شود. NaClO با آزادسازی یون هیپوکلریت (ClO⁻) عمل ضدعفونی کنندگی خود را انجام می دهد. این یون میکروارگانیسم ها را با اکسیداسیون اجزای سلولی از بین می برد. محلول های رقیق هیپوکلریت سدیم برای ضدعفونی سطوح ، ظروف و تجهیزات پزشکی به کار می رود. همچنین در تصفیه آب آشامیدنی برای از بین بردن باکتری ها ، ویروس ها و سایر پاتوژن ها استفاده می شود. از کلر در تولید سایر ترکیبات ضدعفونی کننده مانند دی اکسید کلر (ClO₂) نیز استفاده می شود که به دلیل کارایی و سمیت کمتر در مقایسه با کلر به عنوان جایگزینی برای کلر در برخی از کاربردها مورد توجه قرار گرفته است.
تأثیرات کلر بر سلامت انسان و روش های ایمنی
کلر به عنوان یک گاز زرد-سبز با بوی تند در صورت استنشاق یا تماس مستقیم با پوست و چشم ها اثرات مضری بر سلامت انسان دارد. استنشاق کلر باعث تحریک دستگاه تنفسی ، سرفه ، تنگی نفس و در موارد شدید ادم ریوی می شود. تماس با پوست منجر به سوختگی شیمیایی و التهاب می شود. تماس با چشم باعث سوزش ، درد و آسیب به قرنیه خواهد شد. بلع کلر نیز بسیار خطرناک است و میتواند منجر به آسیب های جدی به دستگاه گوارش شود برای جلوگیری از مسمومیت با کلر اقدامات ایمنی زیر ضروری هستند :
- استفاده از تجهیزات حفاظت فردی مانند ماسک تنفسی ، دستکش ، عینک ایمنی و لباس محافظ هنگام کار با کلر.
-تهویه مناسب محل کار برای جلوگیری از تجمع کلر در هوا.
- ذخیره سازی صحیح کلر در ظروف محکم و در محلی خنک و دور از مواد قابل اشتعال.
-در صورت تماس با کلر بلافاصله منطقه ی آلوده را با آب فراوان بشویید و به پزشک مراجعه کنید.
- آموزش مناسب پرسنل در مورد خطرات کلر و روش های ایمنی نیز بسیار مهم است.
- در صورت بروز هر گونه نشانه مسمومیت بلافاصله به مراکز درمانی مراجعه شود.




