فهرست عناوین
نوشته شده توسط شرکت صنایع کلر ایران
منتشر شده توسط شرکت صنایع کلر ایران
تاریخ انتشار مقاله : 19-10-1403
تاریخ بروزرسانی مقاله : 19-10-1403
تعداد کلمات : 2700
آدرس مقاله : لینک مقاله
روش های تولید کلر

تاریخچه تولید کلر در صنایع شیمیایی
تاریخچه تولید صنعتی کلر به طور مستقیم با کشف آن در سال ۱۷۷۴ توسط کارل ویلهلم شیله گره خورده است. شیله زمانی که مشغول آزمایش بر روی پیرولوزیت (دی اکسید منگنز) و اسید هیدروکلریک بود به طور تصادفی گازی سبز - زرد رنگ با بوی تند و زننده تولید کرد. او این گاز را اسید مورائین نامید اما ماهیت واقعی آن ناشناخته باقی ماند.
همفری دیوی شیمیدان انگلیسی در سال ۱۸۱۰ ماهیت این گاز را مشخص کرد و آن را کلر (Chlorine) نامید از واژه یونانی chloros به معنای سبز- زرد. دیوی با انجام آزمایش های بیشتر نشان داد که این گاز یک عنصر شیمیایی است. این کشف نقطه عطفی در درک خواص شیمیایی کلر و کاربردهای بالقوه آن بود.
استفاده اولیه از کلر عمدتا در زمینه سفید کردن پارچه ها و کاغذها بود که از اواسط قرن نوزدهم به طور گسترده مورد استفاده قرار گرفت. خاصیت سفیدکنندگی قوی کلر به دلیل توانایی آن در از بین بردن رنگدانه ها و مواد آلی است. اما کشف واقعی اهمیت کلر در اواخر قرن نوزدهم و اوایل قرن بیستم اتفاق افتاد زمانی که قدرت ضدعفونی کنندگی آن آشکار شد. مشخص شد که کلر باکتری ها و سایر میکروارگانیسم ها را از بین برده و از شیوع بیماری ها جلوگیری می کند.
در قرن بیستم با پیشرفت تکنولوژی ، تولید صنعتی کلر به طور قابل توجهی افزایش یافت. الکترولیز محلول های نمک طعام (کلرید سدیم) به روش اصلی تولید کلر تبدیل شد. این روش نه تنها کلر بلکه هیدروژن و سود سوزآور را نیز به عنوان محصولات جانبی تولید می کند. امروزه کلر به عنوان ماده اولیه در تولید طیف وسیعی از محصولات شیمیایی از جمله PVC، حلال ها ، مواد ضدعفونی کننده و مواد شیمیایی کشاورزی استفاده می شود.
اهمیت کلر در فرآیندهای صنعتی
کلر به دلیل خاصیت واکنش پذیری بالا و توانایی در ایجاد پیوندهای کووالانسی قوی نقشی اساسی و گسترده در بسیاری از فرآیندهای صنعتی ایفا می کند. اهمیت آن را می توان در چندین حوزه کلیدی مشاهده کرد:
1. کلر یکی از مهم ترین مواد شیمیایی مورد استفاده در تصفیه آب و فاضلاب است. باکتری ها ، ویروس ها و سایر میکروارگانیسم های بیماری زا را از بین برده و آب را برای مصارف خانگی و صنعتی ایمن می سازد. این کاربرد کلر نقش حیاتی در بهداشت عمومی و پیشگیری از شیوع بیماری های آب زا دارد. در تصفیه فاضلاب کلر برای از بین بردن عوامل بیماری زا و کاهش بار آلاینده های آلی قبل از تخلیه به محیط زیست استفاده می شود.
2. کلر ماده اولیه بسیاری از ترکیبات شیمیایی مهم است. از جمله مهم ترین آنها می توان به موارد زیر اشاره کرد:
*PVC (پلی وینیل کلراید)
* حلال ها
* مواد ضدعفونیکننده
* مواد شیمیایی کشاورزی
*مواد دارویی
3. کلر یا ترکیبات آن در صنایع کاغذ و نساجی برای سفید کردن خمیر کاغذ و پارچه استفاده می شود. اگرچه روش های جایگزین با اثرات زیست محیطی کمتر در حال توسعه و جایگزینی هستند. اما کلر هنوز هم در برخی از فرآیندهای این صنایع به کار می رود.
4. کلر در برخی از فرآیندهای استخراج و تصفیه فلزات به کار می رود. به عنوان مثال در استخراج تیتانیوم از سنگ معدن آن استفاده می شود.
5. کلر در تولید مواد شوینده ، رنگ ها ، مواد منفجره و سایر محصولات صنعتی نیز کاربرد دارد.
روش های الکترولیز برای تولید کلر
تولید صنعتی کلر عمدتاً از طریق الکترولیز محلول های کلرید سدیم (نمک طعام) انجام می شود. سه روش اصلی الکترولیز برای این منظور وجود دارد:
1.سلول جیوهای : از جیوه به عنوان کاتد استفاده می شود. کلر در آند تولید شده و آمالگام سدیم تشکیل می شود که با آب واکنش داده و سود سوزآور و هیدروژن تولید می کند. این روش ، سود سوزآور با خلوص بالا تولید می کند. اما به دلیل استفاده از جیوه منسوخ شده است.
2.سلول دیافراگمی : از یک دیافراگم برای جداسازی آند و کاتد استفاده شده است. کلر در آند تولید شده و سود سوزآور با خلوص کمتر در کاتد تولید می شود. این روش ارزان تر و زیست محیطی تر از روش جیوه ای است.
3.سلول غشایی : از یک غشای تبادل یونی استفاده می شود که فقط به یون های سدیم اجازه عبور می دهد. این روش سود سوزآور با خلوص بالا و کلر با کیفیت بالا تولید می کند. با وجود هزینه اولیه بیشتر ، بازده انرژی بالاتر و عدم استفاده از جیوه از مزایای آن است.
فرآیند جیوه ای در تولید کلر
فرآیند جیوه ای روشی قدیمی برای تولید کلر و هیدروکسید سدیم (NaOH) از طریق الکترولیز محلول آب نمک (NaCl) بود. اگرچه این روش زمانی به طور گسترده استفاده می شد. اما به دلیل خطرات جدی زیست محیطی ناشی از استفاده از جیوه تقریباً به طور کامل کنار گذاشته شده است.
در این فرآیند از یک سلول الکترولیتی استفاده می شد که شامل دو الکترود آند و کاتد بود. ویژگی منحصر به فرد این فرآیند استفاده از جیوه مایع به عنوان کاتد بود. جیوه در کف سلول جریان داشت و محلول آب نمک روی آن قرار می گرفت. هنگامی که جریان الکتریکی اعمال می شد واکنش های زیر رخ می دادند:
- در آند یون های کلرید (Cl⁻) در محلول آب نمک اکسید شده و گاز کلر (Cl₂) تولید می شد: Cl⁻ → Cl₂ + 2e2⁻ کلر تولید شده از سلول خارج می شد.
- در کاتد جیوه ای یون های سدیم (Na⁺) از محلول آب نمک به وسیله الکترون ها احیا می شدند و با جیوه ترکیب می شدند تا آملگام سدیم (Na/Hg) تشکیل دهند:
Na⁺ + e⁻ + Hg → Na(Hg) این آملگام محلولی از سدیم در جیوه بود.
آملگام سدیم سپس از سلول خارج شده و به یک راکتور جداگانه منتقل می شد. در این راکتور آملگام سدیم با آب واکنش می داد تا هیدروکسید سدیم (NaOH) و هیدروژن (H₂) تولید شود و جیوه آزاد شود : Na(Hg) + 2H₂O → 2NaOH + H₂ + 2Hg2 جیوه بازیافت شده و به سلول الکترولیتی بازگردانده می شد.
بزرگترین مشکل این فرآیند خطرات جدی زیست محیطی ناشی از استفاده از جیوه بود. حتی مقادیر بسیار کم جیوه برای موجودات زنده بسیار سمی می باشند. و به راحتی در محیط پخش شده و وارد زنجیره غذایی می شوند. عواقب این آلودگی شامل:
* مشکلات جدی برای سلامتی انسان و حیوانات
* آلودگی آب های زیرزمینی و خاک
* پیچیده و هزینه بر بودن دفع پسماندهای خطرناک
فرآیند دیافراگمی در تولید کلر
این روش از یک دیافراگم متخلخل استفاده می کند که آند و کاتد را از هم جدا کرده و از اختلاط مستقیم محصولات حاصل از هر الکترود جلوگیری می کند. این دیافراگم اجازه خواهد داد که یون های کلرید (Cl⁻) به سمت آند حرکت کنند. اما مانع از گذر یون های هیدروکسید (OH⁻) و دیگر نوع های های یونی تولید شده در سمت کاتد به سوی آند می شود.
سلول الکترولیتی دیافراگمی شامل دو الکترود آند و کاتد است که توسط یک دیافراگم متخلخل از هم جدا شده اند. محلول آب نمک (NaCl) از بالای سلول وارد شده و از میان دیافراگم عبور می کند. هنگامی که جریان الکتریکی اعمال می شود ، واکنش های زیر در هر الکترود رخ خواهد داد:
در آند یونهای کلرید (Cl⁻) اکسید شده و گاز کلر (Cl₂) تولید می شود:
2Cl⁻ → Cl₂ + 2e⁻
در کاتد آب احیا شده و هیدروژن (H₂) و یون های هیدروکسید (OH⁻) تولید می شوند:
2H₂O + 2e⁻ → H₂ + 2OH⁻
یون های سدیم (Na⁺) از طریق دیافراگم به سمت کاتد حرکت می کنند. و با یون های هیدروکسید (OH⁻) واکنش می دهند تا محلول هیدروکسید سدیم (NaOH) تولید کنند. غلظت هیدروکسید سدیم در این روش نسبت به روش غشایی کمتر است زیرا برخی از یون های OH⁻ از دیافراگم عبور می کنند و با گاز کلر واکنش می دهند و باعث کاهش راندمان تولید کلر و کاهش خلوص هیدروکسید سدیم می شوند.
نقش اصلی دیافراگم در فرآیند دیافراگمی جلوگیری از اختلاط مستقیم کلر (Cl₂) با هیدروکسید سدیم (NaOH) است. اگر کلر با هیدروکسید سدیم واکنش دهد هیپوکلریت سدیم (NaClO) و کلرات سدیم (NaClO₃) تولید می شود که محصولات ناخواسته هستند و راندمان تولید کلر و NaOH را کاهش می دهد.
فرآیند غشایی در تولید کلر
فرآیند غشایی روشی پیشرفته در تولید کلر و هیدروکسید سدیم (NaOH) از طریق الکترولیز محلول آب نمک (NaCl) است. برخلاف روش های قدیمی تر مانند فرآیند جیوه ای و دیافراگمی ، این روش از یک غشای تبادل یونی با نفوذپذیری انتخابی استفاده می کند. که به طور مؤثر آند و کاتد را از هم جدا کرده و از اختلاط محصولات جلوگیری میکند. این امر باعث تولید محصولات با خلوص بالاتر و کاهش چشمگیر اثرات زیانبار بر محیط زیست میشود.
سلول الکترولیتی غشایی شامل دو محفظه مجزا است که توسط یک غشای تبادل یونی از جنس پلیمری مانند پرفلئوروسولفونیک اسید (PFSA) از هم جدا شده اند. محلول آب نمک در محفظه آند و آب خالص (یا محلول رقیق شده هیدروکسید سدیم) در محفظه کاتد جریان دارد. اعمال جریان الکتریکی باعث وقوع واکنش های زیر می شود:
- در آند یون های کلرید (Cl⁻) اکسید شده و گاز کلر (Cl₂) تولید می شود:
2Cl⁻ → Cl₂ + 2e⁻
کلر تولید شده به عنوان محصول اصلی از سلول خارج میشود.
- در کاتد آب (H₂O) احیا شده و هیدروژن (H₂) و یون های هیدروکسید (OH⁻) تولید می شوند:
2H₂O + 2e⁻ → H₂ + 2OH⁻
همزمان یون های سدیم (Na⁺) از محلول آب نمک از طریق غشا به محفظه کاتد مهاجرت می کنند. یون های سدیم و هیدروکسید ترکیب شده و محلول هیدروکسید سدیم (NaOH) با خلوص بالا را تشکیل می دهند. این محلول به عنوان محصول جانبی از سلول خارج می شود.
غشای تبادل یونی فقط به یون های سدیم (Na⁺) اجازه عبور از محفظه آند به کاتد را می دهد و از عبور یون های کلرید (Cl⁻) و هیدروکسید (OH⁻) جلوگیری می کند. این جداسازی کامل و دقیق ، خلوص هیدروکسید سدیم را به طور قابل توجهی افزایش داده و از واکنش های جانبی ناخواسته بین کلر و هیدروکسید سدیم جلوگیری خواهد کرد. در مجموع فرآیند غشایی به عنوان یک تکنولوژی پیشرفته و دوستدار محیط زیست در تولید کلر و هیدروکسید سدیم شناخته شده است و به طور فزاینده ای در صنایع شیمیایی جایگزین روش های قدیمیتر است.
محصولات جانبی تولید کلر
در فرآیند تولید کلر از طریق الکترولیز محلول آب نمک علاوه بر کلر دو محصول جانبی ارزشمند دیگر نیز تولید می شوند : هیدروکسید سدیم (NaOH) و هیدروژن (H₂) ، این محصولات به طور همزمان و در دو الکترود مختلف سلول الکترولیتی تولید می شوند.
هیدروکسید سدیم یک باز قوی است که در صنایع مختلف از جمله تولید کاغذ ، صابون ، شوینده ها و مواد شیمیایی دیگر کاربرد گسترده ای دارد. هیدروژن نیز به عنوان یک گاز قابل اشتعال و منبع انرژی پاک در تولید آمونیاک ، پالایش نفت و به عنوان سوخت در پیل های سوختی کاربرد دارد. ارزش تجاری این دو محصول جانبی مهم ترین دلیل اقتصادی بودن فرآیند الکترولیز آب نمک در مقیاس صنعتی است.
| ردیف | محصول جانبی | فرمول شیمیایی | روش تولید | کاربردها | خطرات و ملاحظات |
|---|---|---|---|---|---|
| 1 | گاز هیدروژن | H₂ | تولید شده در فرآیند الکترولیز محلول نمک | سوخت، تولید آمونیاک، هیدروژنه کردن روغنها، تولید متانول | قابل اشتعال، خطر انفجار |
| 2 | سود سوزآور | NaOH | تولید شده در کاتد الکترولیز | تولید کاغذ، صابون، مواد شوینده، تصفیه نفت | خورنده، نیاز به رعایت نکات ایمنی |
| 3 | هیپوکلریت سدیم | NaOCl | واکنش کلر با سود سوزآور | ضدعفونیکننده، سفیدکننده، تصفیه آب | حساس به نور، ایجاد گاز کلر در محیط اسیدی |
| 4 | اسید کلریدریک | HCl | در برخی واکنشهای تولید کلر | تصفیه فلزات، تولید ترکیبات آلی، تمیز کردن صنعتی | خورنده، بخارات خطرناک |
| 5 | دیاکسید کلر | ClO₂ | تولید شده از واکنش کلر و کلریتها | ضدعفونی آب، سفیدکننده در صنایع کاغذ | قابل انفجار در غلظتهای بالا |
| 6 | کلرات سدیم | NaClO₃ | در فرآیندهای خاص تولید کلر | سفیدکننده در صنعت کاغذ، تولید مواد منفجره | حساس به گرما و شوک |
| 7 | تریکلرید نیتروژن | NCl₃ | ممکن است به عنوان محصول جانبی در برخی واکنشهای کلر ظاهر شود | در شرایط خاص به عنوان معرف شیمیایی استفاده میشود | بسیار ناپایدار و انفجاری |
| 8 | کلرید کلسیم | CaCl₂ | واکنش کلر با کربنات کلسیم یا در فرآیندهای دیگر | خشککننده، ضدیخ، تثبیت خاک | غیرسمی اما تحریککننده برای پوست |
| 9 | کلروفورم | CHCl₃ | ممکن است در فرآیند کلرزنی ترکیبات آلی در آب تشکیل شود | استفاده در صنعت داروسازی و شیمیایی | سمی و سرطانزا |
| 10 | برم | Br₂ | در فرآیندهای کلر/نمک دریا میتواند به عنوان محصول جانبی استخراج شود | تولید ترکیبات شیمیایی، ضدعفونی آب استخر | خورنده و سمی |
مقایسه روش های مختلف تولید کلر
سه روش اصلی برای تولید کلر از طریق الکترولیز محلول آب نمک وجود دارد : دیافراگمی ، غشایی و جیوه ای. روش جیوه ای به دلیل خطرات زیست محیطی شدید ناشی از استفاده از جیوه تقریباً منسوخ شده است. روش دیافراگمی از یک دیافراگم متخلخل برای جداسازی آند و کاتد استفاده می کند. که منجر به تولید هیدروکسید سدیم رقیق (10- 12%) با خلوص پایین می شود و راندمان انرژی آن نسبتاً پایین است. هزینه اولیه این روش کم است اما هزینه های عملیاتی به دلیل نیاز به تغلیظ هیدروکسید سدیم بالا است.
روش غشایی از یک غشای تبادل یونی با گزینش پذیری بالا استفاده می کند. که سبب تولید هیدروکسید سدیم غلیظ (30- 35%) با خلوص بالا و راندمان انرژی بالا می شود. با وجود هزینه اولیه بالاتر ، هزینه های عملیاتی پایین تر و کیفیت محصول بالاتر ، این روش را به گزینه مد نظر در فرآیند خرید کلر استخر تبدیل کرده است.
روش جیوه ای که از جیوه مایع به عنوان کاتد استفاده می کند ، هیدروکسید سدیم با خلوص بسیار بالا تولید می کرد و راندمان بالایی داشت. اما به دلیل خطرات زیست محیطی بسیار جدی مرتبط با سمیت جیوه و دشواری در دفع ایمن آن ، این روش تقریباً به طور کامل کنار گذاشته شده و جای خود را به روش های دیافراگمی و غشایی داده است.
در مقایسه کلی روش غشایی به دلیل راندمان انرژی بالاتر ، کیفیت محصول برتر و ایمنی زیست محیطی بیشتر بهترین گزینه برای تولید کلر و هیدروکسید سدیم در مقیاس صنعتی است هرچند هزینه اولیه آن بالاتر است. روش دیافراگمی همچنان به عنوان یک گزینه اقتصادی تر اما کم بازده تر مورد استفاده قرار می گیرد.
فناوری های نوین در تولید کلر
فناوری های نوین در تولید کلر به طور قابل توجهی بر بهرهوری ، ایمنی و پایداری فرآیند تولید تاثیر گذاشته اند. این پیشرفت ها عمدتا در سه حوزه متمرکز شده اند: بهینه سازی الکترولیز ، مدیریت انرژی و بهبود ایمنی و کاهش ضایعات. در حوزه الکترولیز استفاده از غشاهای تبادل یونی پیشرفته با گزینش پذیری و دوام بالاتر راندمان فرآیند را افزایش داده و تلفات انرژی را کاهش می دهد. مواد جدید کاتالیزوری در آند و کاتد نیز سرعت واکنش ها را بالا برده و افت ولتاژ را کاهش می دهند.
سیستم های کنترل هوشمند مبتنی بر هوش مصنوعی (AI) و یادگیری ماشین (ML)، فرآیند را در زمان واقعی پایش و بهینه سازی می کنند و از وقوع توقف های ناخواسته جلوگیری می نمایند. الکترولیز جامد اگرچه هنوز در مراحل توسعه اولیه است اما نوید راندمان و ایمنی بالاتر را می دهد.
مدیریت انرژی نیز نقش مهمی دارد. استفاده از انرژی های تجدیدپذیر مانند خورشیدی و بادی در حال افزایش است و بازیابی حرارت از فرآیند الکترولیز برای تولید بخار یا گرمایش در سایر بخش ها به بهبود بازده کلی انرژی کمک می کند. طراحی های جدید سلول های الکترولیتی نیز به کاهش مصرف انرژی کمک می کنند.
در نهایت سیستم های مانیتورینگ و کنترل پیشرفته ایمنی را بهبود می بخشند و از خطرات احتمالی مانند نشت جلوگیری می کنند. فناوری های نوین در مدیریت پسماند ها به کاهش انتشار مواد شیمیایی مضر به محیط زیست و بازیافت مواد کمک می کنند. اتوماسیون و رباتیک نیز با رعایت ملاحضات ایمنی در استفاده از کلر ، خطرات انسانی را به حداقل می رسانند. در کل این پیشرفت ها به تولید کلر با راندمان بالاتر ، هزینه کمتر ، ایمنی بیشتر و ردپای زیست محیطی پایین تر منجر شده اند.
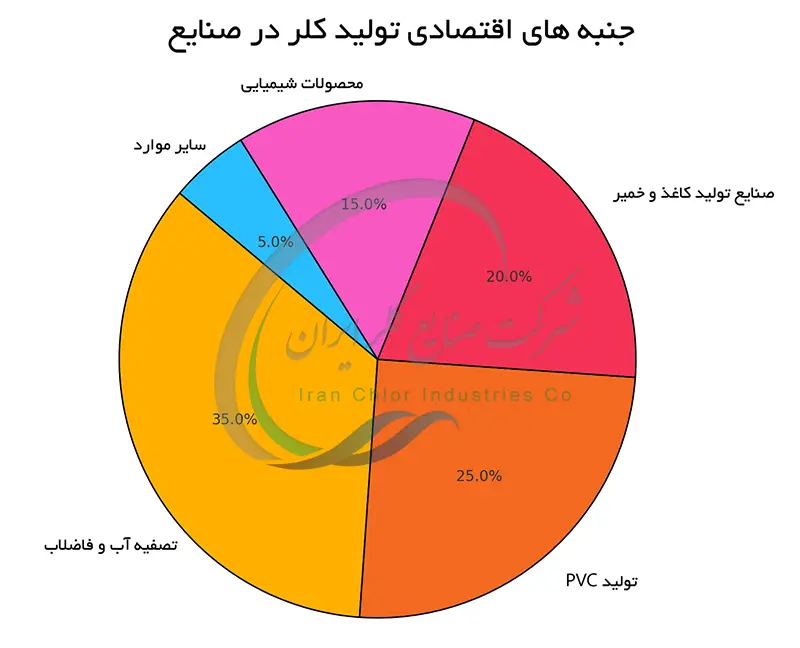
جنبه های اقتصادی تولید کلر در صنایع
هزینه تولید کلر به طور عمده به قیمت انرژی الکتریکی و نمک طعام که مواد اولیه اصلی هستند وابسته است. قیمت انرژی الکتریکی که بخش قابل توجهی از هزینه های تولید را به خود اختصاص می دهد می تواند نوسانات قابل توجهی داشته باشد و تحت تأثیر عوامل مختلفی مانند قیمت سوخت های فسیلی و سیاست های دولتی قرار گیرد.
علاوه بر این هزینه های سرمایه گذاری اولیه برای ساخت و راه اندازی تأسیسات الکترولیز ، هزینه های تعمیر و نگهداری تجهیزات ، دستمزد کارکنان و هزینه های حمل و نقل نیز به هزینه های کلی تولید کلر اضافه می شوند. همچنین نرخ ارز و هزینه های زیست محیطی (مانند هزینه های تصفیه آب و دفع پسماند) بر قیمت تمام شده کلر تاثیرگذار هستند.
بازار جهانی کلر تحت تأثیر تقاضای صنایع مختلف مانند تولید پلاستیک (PVC)، کاغذسازی ، آب آشامیدنی ، تصفیه فاضلاب و تولید مواد شیمیایی قرار دارد. نوسانات در تقاضای جهانی این صنایع بر قیمت کلر تاثیر گذاشته و منجر به افزایش یا کاهش قیمت خواهد شد. عوامل دیگری مانند رقابت بین تولیدکنندگان ، سیاست های تجاری بین المللی ، عرضه و تقاضای مواد اولیه نیز در تعیین قیمت کلر در بازار جهانی نقش دارند. در حالت کلی یک تعادل ظریف بین هزینه های تولید و تقاضای بازار ، قیمت کلر را در سطح جهانی تعیین می کند.





واکنش های شیمیایی کلر با ترکیبات گوناگون
الکترولیز نمک طعام
بررسی فرآیندهای نوین تولید کلر