فهرست عناوین
- واکنش های شیمیایی کلر با فلزات : بررسی تعاملات کلر با فلزات مختلف
- واکنش های کلر با هیدروکربن ها : تشکیل ترکیبات آلی
- واکنش کلر با آب : تشکیل اسید هیدروکلریک و اسید هیپوکلروس
- واکنش کلر با آمونیاک : تولید گازهای سمی
- واکنش های کلر با هیدروژن : تولید هیدروژن کلرید
- واکنش های کلر با ترکیبات آلی : هالوژنه سازی
- واکنش کلر با سولفیدها : تولید ترکیبات سولفوری
- واکنش های کلر با گازهای طبیعی : اثرات بر گازهای گلخانه ای
- تاثیرات کلر بر پروتئین ها و آنزیم ها : تخریب ساختارهای زیستی
- واکنش های کلر با نیتروژن : تولید ترکیبات نیتروژنی
- واکنش کلر با الکل ها : تولید کلریدهای آلی
- واکنش های کلر با اسیدها : تولید نمک های کلریدی
- پایداری ترکیبات کلر : واکنش های برگشتی و تجزیه
- کاربردهای صنعتی واکنش های کلر : از تصفیه آب تا تولید پلاستیک
نوشته شده توسط شرکت صنایع کلر ایران
منتشر شده توسط شرکت صنایع کلر ایران
تاریخ انتشار مقاله : 25-10-1403
تاریخ بروزرسانی مقاله : 25-10-1403
تعداد کلمات : 2400
آدرس مقاله : لینک مقاله
واکنش های شیمیایی کلر با ترکیبات گوناگون

واکنش های شیمیایی کلر با فلزات : بررسی تعاملات کلر با فلزات مختلف
کلر (Cl₂)به عنوان یک اکسید کننده قوی با بسیاری از فلزات واکنش داده و کلریدهای فلزی تولید می کند. این واکنش ها که اغلب گرمازا هستند سبب تشکیل یک لایه از کلرید فلزی بر روی سطح فلز می شوند. شدت و سرعت این واکنش به عواملی مانند نوع فلز ، دمای محیط و غلظت کلر بستگی دارد. آهن در مجاورت رطوبت با کلر واکنش داده و کلرید آهن(II) و کلرید آهن(III) تولید می کند که منجر به خوردگی و زنگ زدگی می شود. آلومینیوم نیز با کلر واکنش داده و کلرید آلومینیوم تشکیل می شود. با این حال لایه نازک و محافظ اکسید آلومینیوم روی سطح ، سرعت این واکنش را کاهش می دهد.
مس نسبت به آهن و آلومینیوم مقاومت بیشتری در برابر کلر دارد. در شرایط عادی واکنش مس با کلر کند است اما در دماهای بالا کلرید مس(II) تشکیل می شود. تحلیل این واکنش ها از جنبههای ترمودینامیکی و سینتیکی درک عمیق تری از رفتار خوردگی فلزات در مجاورت کلر ارائه می دهد و در انتخاب مواد مناسب در صنایع مختلف به ویژه صنایع شیمیایی و مرتبط با آب بسیار مهم است. این واکنش ها نقش مهمی در فرآیندهای صنعتی مانند تولید کلریدهای فلزی و تصفیه ی آب دارند.
واکنش های کلر با هیدروکربن ها : تشکیل ترکیبات آلی
کلر با هیدروکربن ها واکنش داده و طیف وسیعی از ترکیبات آلی کلردار تشکیل می گردد . این واکنش ها که اغلب به عنوان واکنش های هالوژناسیون شناخته می شوند شامل جایگزینی اتم های هیدروژن در مولکول هیدروکربن با اتم های کلر هستند. نوع واکنش و محصولات حاصل به عوامل مختلفی مانند نوع هیدروکربن (آلکان ، آلکن ، آلکین یا آروماتیک) ، شرایط واکنش (نور ، دما ، حضور کاتالیزور) و نسبت کلر به هیدروکربن بستگی دارد.
واکنش های جایگزینی رادیکالی در آلکان ها معمولاً در حضور نور UV اتفاق می افتند و باعث تشکیل هالیدهای آلکیل می شوند. در آلکن ها و آلکین ها ، کلر به پیوند دوگانه یا سه گانه اضافه می شود و دیکلریدها یا تتراکلریدها را تشکیل می دهد. واکنش های کلر با هیدروکربن های آروماتیک مانند بنزن ، نیازمند کاتالیزور هستند و محصولات کلردار آروماتیک را به وجود می آورند. این ترکیبات آلی کلردار کاربردهای فراوانی در صنایع مختلف از جمله تولید حلال ها ، مواد ضدعفونی کننده و آفت کش ها دارند.
واکنش کلر با آب : تشکیل اسید هیدروکلریک و اسید هیپوکلروس
کلر با آب واکنش داده و مخلوطی از اسید هیدروکلریک (HCl) و اسید هیپوکلروس (HOCl) را تشکیل می دهد. این واکنش تعادلی است که به pH آب بستگی دارد. در آب خنثی یا قلیایی، HOCl غالب است در حالی که در آب اسیدی، HCl غالب خواهد بود. HOCl به عنوان عامل اصلی ضدعفونیکنندگی در این فرایند عمل می کند. توانایی HOCl در از بین بردن باکتری ها ، ویروس ها و سایر میکروارگانیسم ها به دلیل قدرت اکسیدکنندگی بالای آن است. با این حال HOCl به تدریج به یون هیپوکلریت (OCl⁻) تبدیل می شود که قدرت ضدعفونیکنندگی کمتری دارد.
افزایش pH باعث افزایش غلظت OCl⁻ و کاهش کارایی ضدعفونیکنندگی می شود. بنابراین کنترل pH آب در فرآیند ضدعفونی با کلر و خرید پودر کلر استخر بسیار مهم است تا اطمینان حاصل شود. که غلظت کافی از HOCl برای دستیابی به ضدعفونی موثر وجود دارد. این واکنش همچنین سبب کاهش pH آب می شود که در سیستم های آب رسانی نیاز به تنظیم مجدد pH را ضروری می سازد.
واکنش کلر با آمونیاک : تولید گازهای سمی
واکنش کلر با آمونیاک یک واکنش گرمازا و بسیار خطرناک است که سبب تولید گازهای سمی و خورنده می شود. در این واکنش بسته به نسبت واکنش دهنده ها و شرایط محیطی ، ترکیبات از جمله مونوکلرامین (NH₂Cl) ، دی کلرامین (NHCl₂)و تری کلرامین (NCl₃)تولید می شوند. مونوکلرامین در غلظت های پایین به عنوان ضدعفونیکننده در تصفیه ی آب استفاده می شود اما در غلظت های بالا سمی و خطرناک است. دی کلرامین و تری کلرامین گازهایی بسیار سمی و خورنده هستند که به دستگاه تنفسی آسیب جدی وارد می کنند.
تریکلرامین به ویژه ناپایدار و انفجاری است. واکنش کلر با آمونیاک در صنایع مختلف از جمله تصفیه ی آب و تولید کودهای شیمیایی میتواند رخ دهد و رعایت کامل نکات ایمنی برای جلوگیری از بروز حوادث بسیار مهم است. استفاده از تجهیزات حفاظتی مناسب و کنترل دقیق نسبت واکنشدهنده ها از ضروریات این فرآیندهاست.
واکنش های کلر با هیدروژن : تولید هیدروژن کلرید
واکنش کلر با هیدروژن یک واکنش گرمازا و بسیار سریع است که به تولید هیدروژن کلرید (HCl) می انجامد. این واکنش با ترکیب مستقیم گاز کلر (Cl₂) و گاز هیدروژن (H₂) در شرایط مناسب انجام می شود. این فرآیند به شکل زیر نمایش داده می شود.H₂ + Cl₂ → 2HCl
این واکنش به شدت تحت تأثیر نور قرار دارد و حتی در حضور نور کم نیز با سرعت قابل توجهی انجام می گردد. در برخی موارد واکنش به صورت انفجاری رخ می دهد. به همین دلیل کنترل شرایط واکنش (مانند دما ، فشار و نسبت واکنش دهنده ها) بسیار مهم است.
هیدروژن کلرید تولیدی یک گاز بی رنگ و بسیار خورنده است که به راحتی در آب حل شده و اسید هیدروکلریک (HCl(aq)) را تشکیل می دهد و می تواند در برخی از فرآیندهای تولید نمک طعام جهت الکترولیز نمک طعام مورد استفادهقرار گیرد. اسید هیدروکلریک یک اسید معدنی قوی است که در صنایع مختلف از جمله تولید مواد شیمیایی ، صنایع غذایی ، داروسازی و تصفیه ی فلزات کاربرد گسترده ای دارد. تولید هیدروژن کلرید از طریق واکنش مستقیم کلر و هیدروژن یک روش صنعتی مهم برای تولید این ماده شیمیایی پرکاربرد است.
واکنش های کلر با ترکیبات آلی : هالوژنه سازی
هالوژنه سازی افزودن هالوژن ها (مانند کلر) به ترکیبات آلی ، واکنشی گسترده با کاربردهای صنعتی فراوان است. در مورد آلکن ها کلر به پیوند دوگانه اضافه می شود و یک ترکیب دی هالید آلکیل را تشکیل می دهد. این واکنش الکتروفیلیک است و بدون نیاز به کاتالیزور انجام می شود. برای مثال واکنش اتیلن با کلر ، 1,2-دی کلرواتان را تولید می کند. این نوع واکنش در تولید حلال ها و سایر مواد شیمیایی کاربرد دارد.
در مورد ترکیبات آروماتیک واکنش هالوژنه سازی پیچیده تر است و معمولاً به کاتالیزور مانند FeCl₃ نیاز دارد. کلر به حلقه بنزن اضافه می شود و یک محصول کلردار آروماتیک را تشکیل می دهد. برای مثال کلرزنی بنزن ، کلروبنزن را تولید می کند. این واکنش ها در تولید آفتکش ها، مواد پلاستیکی و سایر ترکیبات آلی کلردار نقش اساسی دارند. انتخاب شرایط واکنش مانند دما ، فشار و حضور کاتالیزور کنترل روی محصولات و میزان واکنش را امکان پذیر می کند.
| نوع ترکیب آلی | شرایط واکنش | محصول واکنش | نوع مکانیزم |
|---|---|---|---|
| آلکانها | نور یا حرارت (رادیکالی) | آلکیل کلرید (R-Cl) | رادیکالی |
| آلکنها | در حضور UV یا پراکسید | کلروآلکانها | الکترونیدوستی افزایشی |
| آلکینها | در شرایط سختتر با کاتالیزور | کلروآلکنها | الکترونیدوستی افزایشی |
| آروماتیکها | در حضور کلر و کاتالیزور FeCl3 | کلروبنزنها | الکترونیدوستی جانشینی |
| الکلها | اکسایش به آلدهیدها و اسیدها | کلرینات شده یا اکسید شده | اکسایش |
واکنش کلر با سولفیدها : تولید ترکیبات سولفوری
کلر (Cl₂) با سولفیدها (S²⁻) واکنش پذیری بالایی نشان می دهد. و در فرآیندی گرمازا ترکیبات سولفوری مختلفی را تولید می کند. نوع و میزان محصول تولیدی به عوامل متعددی از جمله نوع سولفید ، نسبت واکنش دهنده ها ، دما و حضور کاتالیزور بستگی دارد. یکی از مهم ترین محصولات این واکنش سولفور کلریدها مانند S₂Cl₂ هستند. سولفور مونوکلرید (S₂Cl₂) مایعی قرمز تیره و فرار است که به طور گسترده در ولکانیزاسیون لاستیک استفاده می شود. واکنش کلر با سولفور عنصری در شرایط کنترل شده این ترکیب را تولید می کند.
واکنش کلر با سولفیدهای فلزی به تولید کلریدهای فلزی و آزاد شدن سولفور یا ترکیبات سولفوری دیگر می انجامد. به عنوان مثال واکنش کلر با سولفید آهن (FeS) به تولید کلرید آهن (FeCl₂) و سولفور یا سولفور کلریدها منجر می شود. کاربردهای صنعتی ترکیبات سولفوری حاصل از واکنش کلر و سولفیدها گسترده است از صنایع لاستیک سازی تا سنتز ترکیبات آلی. باید توجه داشت که بسیاری از این ترکیبات سمی و خورنده هستند و باید با رعایت کامل نکات ایمنی با آن ها برخورد شود.
واکنش های کلر با گازهای طبیعی : اثرات بر گازهای گلخانه ای
واکنش های کلر با گازهای طبیعی عمدتا متان (CH₄) اثرات قابل توجهی بر محیط زیست و گازهای گلخانه ای داشته باشد. کلر با متان واکنش داده و ترکیبات آلی کلردار تولید خواهد کرد. این ترکیبات پتانسیل گرمایش جهانی متفاوتی دارند که برخی از آنها بسیار قوی تر از خود متان هستند. واکنش های کلر به تخریب لایه اوزون کمک کرده که باعث افزایش تابش فرابنفش خورشید به زمین می شود. از سوی دیگر کلر با اکسیدهای نیتروژن واکنش می دهد و باعث کاهش انتشار این گازهای گلخانه ای می شود. بنابراین تاثیر کلی واکنش های کلر با گازهای طبیعی بر گازهای گلخانه ای پیچیده است و به عوامل متعددی مانند نسبت واکنش دهنده ها ، شرایط محیطی و نوع ترکیبات تشکیل شده بستگی دارد.
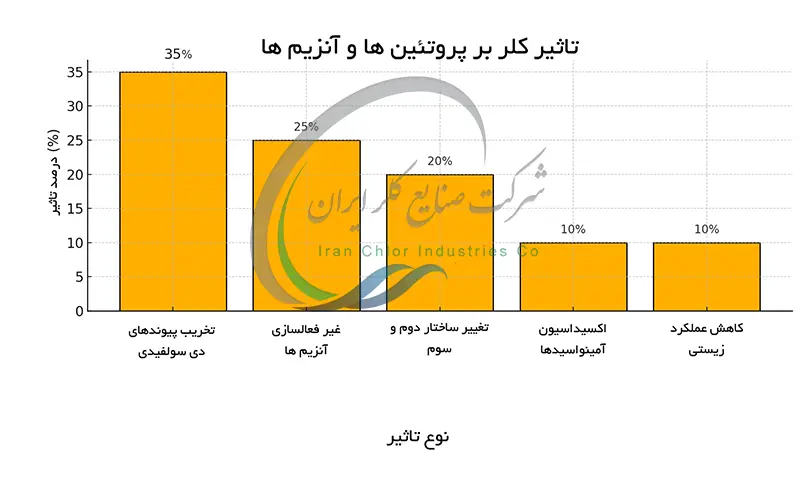
تاثیرات کلر بر پروتئین ها و آنزیم ها : تخریب ساختارهای زیستی
کلر به عنوان یک اکسیدکننده قوی تأثیرات مخربی بر ساختارهای زیستی به ویژه پروتئین ها و آنزیم ها دارد. مکانیسم تخریب شامل اکسیداسیون اسیدهای آمینه بهویژه متیونین ، سیستئین و تریپتوفان است که پیوندهای پپتیدی و ساختارهای ثانویه ، سومیه و چهارجیه پروتئین را مختل می کند. این اکسیداسیون منجر به تغییر شکل و از دست رفتن فعالیت زیستی پروتئین ها و آنزیم ها می شود.
کلر با گروه های عاملی مختلف در زنجیره جانبی اسیدهای آمینه واکنش داده و پیوندهای عرضی ایجاد می کند که این امر باعث تجمع پروتئین ها و از کار افتادن سیستم های سلولی می شود. شدت تخریب به غلظت کلر ، زمان تماس و نوع پروتئین بستگی دارد. در نتیجه کلر عملکرد سلول ها و بافت ها را مختل کرده و اثرات سمی شدیدی را به دنبال داشته است.
واکنش های کلر با نیتروژن : تولید ترکیبات نیتروژنی
واکنش های کلر با ترکیبات نیتروژنی طیف وسیعی از ترکیبات نیتروژن دار را تولید می کند که کاربردهای گسترده ای در صنایع شیمیایی و داروسازی دارند. این واکنش ها بسته به نوع ترکیب نیتروژنی و شرایط واکنش (دما ، فشار ، کاتالیزور) محصولات مختلفی را بهوجود می آورند. برای مثال واکنش کلر با آمونیاک (NH₃) به تولید مونوکلروآمین (NH₂Cl) ، دی کلروآمین (NHCl₂) و حتی تری کلروآمین (NCl₃) منجر می شود. این ترکیبات به عنوان عوامل ضدعفونیکننده و سفیدکننده در صنایع مختلف مورد استفاده قرار می گیرند.
واکنش کلر با نیتروژن اکسیدها نیز ترکیبات جدیدی تولید می کند که برخی از آن ها در تولید کودهای شیمیایی و یا به عنوان پیش ماده در سنتز سایر ترکیبات کاربرد دارند. همچنین کلر با ترکیبات آلی نیتروژن دار ، مانند آمین ها و آمیدها واکنش داده و ترکیبات کلردار جدیدی را تولید می کند که در صنعت داروسازی بهعنوان پیش ماده برای ساخت داروها مورد استفاده قرار می گیرند. کنترل دقیق شرایط واکنش برای تولید محصول مورد نظر و جلوگیری از تشکیل محصولات جانبی ناخواسته بسیار حائز اهمیت است.
واکنش کلر با الکل ها : تولید کلریدهای آلی
کلر به عنوان یک عامل اکسیدکننده و کلرزنی قوی با الکل ها واکنش داده و طیف وسیعی از ترکیبات کلریدی آلی را تولید می کند. این واکنش ها که معمولاً به عنوان جایگزینی هسته دوستی شناخته می شوند منجر به تشکیل کلریدهای آلیل ، کلریدهای بنزیل و یا سایر مشتقات کلردار می شوند. نوع محصول تولیدی به ساختار الکل و شرایط واکنش از جمله دما ، حلال و کاتالیزور بستگی دارد. کلریدهای آلی حاصل به عنوان واسطه های مهم در سنتز ترکیبات آلی پیچیده تر از جمله داروها ، آفتکش ها و حلال ها در صنایع داروسازی و شیمیایی کاربرد دارند.
واکنش های کلر با اسیدها : تولید نمک های کلریدی
کلر به عنوان یک اکسیدکننده قوی با اسیدهای مختلف واکنش می دهد و نمک های کلریدی تولید می کند. این واکنش ها اغلب به عنوان واکنش های جانشینی یا اکسیداسیون-کاهش طبقه بندی می شوند. واکنش کلر با اسید سولفوریک (H₂SO₄) یک نمونه بارز است. در این واکنش کلر با یون های سولفات واکنش داده و هیدروژن کلرید (HCl) و اکسیدهای سولفور را تولید میکند.
HCl سپس با مواد قلیایی واکنش می دهد تا نمک های کلریدی مانند سدیم کلرید (NaCl) تشکیل دهد. نوع نمک کلریدی تولیدی به نوع اسید و قلیایی مورد استفاده بستگی دارد. این واکنش ها در صنایع شیمیایی کاربردهای زیادی دارند از جمله تولید اسید کلریدریک (HCl) که در تولید بسیاری از ترکیبات شیمیایی دیگر استفاده می شود. همچنین از این واکنش ها در سنتز برخی ترکیبات آلی کلردار استفاده می شود. علاوه بر اسید سولفوریک کلر با سایر اسیدهای معدنی مانند اسید نیتریک و اسید فسفریک واکنش داده و نمک های کلریدی مربوطه را تولید می کند. بسیاری از این واکنش ها گرمازا هستند و باید با احتیاط انجام شوند.
پایداری ترکیبات کلر : واکنش های برگشتی و تجزیه
پایداری ترکیبات کلر به عوامل متعددی از جمله نوع پیوند شیمیایی ، ساختار مولکولی و شرایط محیطی دما، فشار ، pH و حضور کاتالیزورها بستگی دارد. برخی ترکیبات کلر مانند نمک های کلرید فلزی بسیار پایدار هستند در حالی که سایرین مانند برخی از ترکیبات آلی کلردار تمایل به تجزیه دارند. واکنش های برگشتی منجر به تولید مجدد مواد اولیه یا تشکیل ترکیبات جدید می شوند. تجزیه ترکیبات کلر از طریق مکانیسم های مختلفی از جمله واکنش های هیدرولیز ، اکسیداسیون-کاهش و واکنشهای رادیکالی آزاد صورت می گیرد.
محصولات حاصل از تجزیه اغلب شامل یون کلرید (Cl⁻) و دیگر ترکیبات کلردار یا غیرکلردار هستند. درک پایداری و واکنش های ترکیبات کلر در زمینه های مختلف مانند تصفیه آب ، سنتز شیمیایی و محیط زیست بسیار مهم است. مطالعه ی این واکنش ها به پیشبینی رفتار ترکیبات کلر در سیستم های مختلف و کنترل تشکیل محصولات جانبی ناخواسته کمک می کند.
کاربردهای صنعتی واکنش های کلر : از تصفیه آب تا تولید پلاستیک
واکنش های کلر با ترکیبات مختلف کاربردهای صنعتی گسترده ای دارد. در تصفیه آب کلر به عنوان یک ضدعفونیکننده قوی ، باکتری ها ، ویروس ها و سایر میکروارگانیسم های مضر را از بین می برد و از شیوع بیماری های آب زا جلوگیری می کند. این فرآیند با اکسیداسیون و از بین بردن ترکیبات آلی موجود در آب نیز همراه است.
در صنعت پلاستیک کلر در تولید پلی وینیل کلراید (PVC) نقش حیاتی دارد. PVC یک پلاستیک همه کاره است که در طیف وسیعی از محصولات مانند لوله ها ، پوشش کف و لباس استفاده می شود. کلرزنی آلکن ها مرحله کلیدی در سنتز مونومر وینیل کلراید (VCM) است که سپس به PVC پلیمریزه می شود. صنایع شیمیایی نیز از واکنش های کلر برای تولید طیف وسیعی از مواد شیمیایی از جمله حلال ها ، رنگ ها و آفتکش ها استفاده می کنند. کلر در سنتز بسیاری از مواد شیمیایی آلی و معدنی به عنوان یک عامل کلرزنی یا اکسیدکننده نقش مهمی ایفا می کند.




